İyonlaşma enerjisi, kimyanın temel taşlarından biri olarak merak uyandıran bir konudur. Vatandaşlar, elementler arasındaki bu önemli özelliğin nasıl değiştiğini anlamak için "İyonlaşma enerjisi nereye doğru artar? İyonlaşma enerjisi soldan sağa doğru artar mı?" gibi temel soruları araştırıyorlar. Bu araştırma, kimyanın derinliklerine inmek ve periyodik tablodaki gizemleri çözmek için bir adım atmanın heyecan verici bir yoludur. Şimdi, bu konudaki detaylara birlikte göz atalım.
İyonlaşma enerjisi nereye doğru artar?
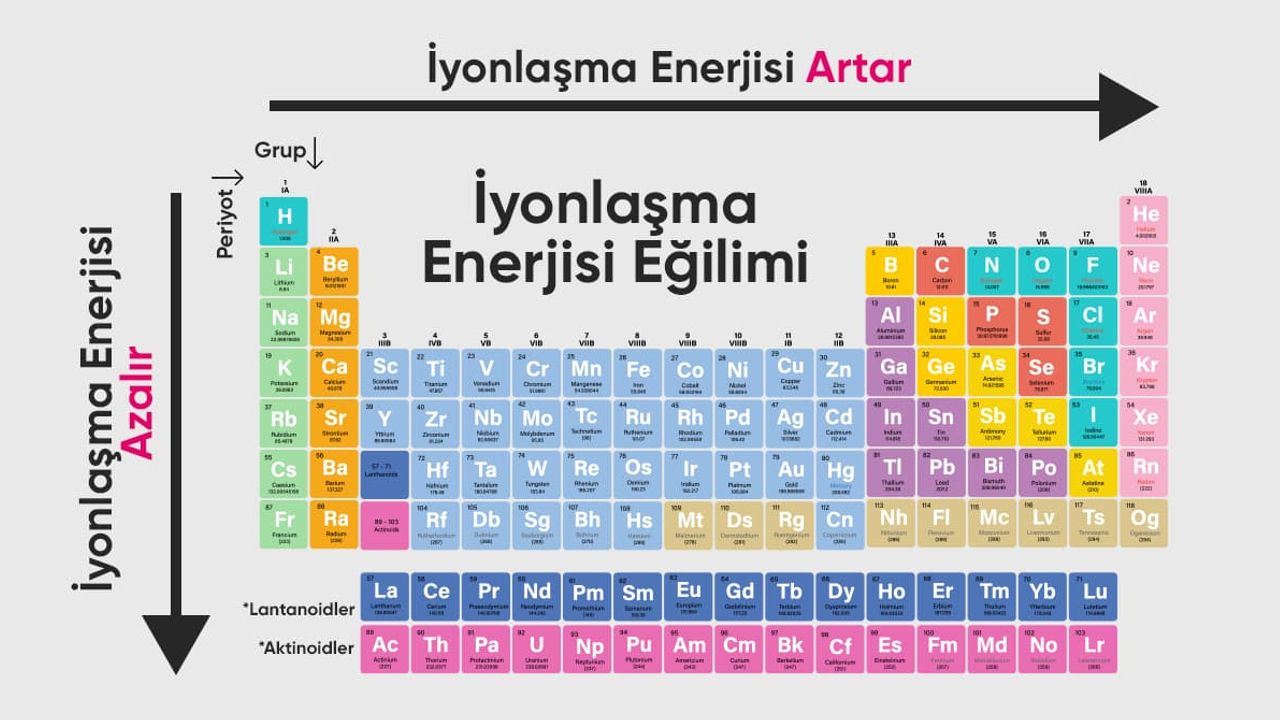
Atomik yapının, periyodik çizelgedeki değişimlerin ve kimyasal reaksiyonların anlaşılmasında temel bir rol oynayan iyonlaşma enerjisi, bazı kişiler için karmaşık kavramlar arasında yer alır. İyonizasyon enerjisi olarak da bilinen bu kavram, herhangi bir atomun temel durumdaki elektronunu atomdan ayırmak için gereken enerji miktarını ifade eder. İyonizasyon, atomların kararlı hale geçme sürecinin genel adı olup, kimyanın temel olaylarından biridir.
İyonlaşma enerjisi soldan sağa doğru artar mı?
Fizik ve kimya bilimlerinde sıkça karşılaşılan iyonlaşma enerjisi kavramı, her iki alanda da farklı birimlerle ifade edilir. Fizikte, iyonlaşma enerjisi Elektron Volt (EV) cinsinden belirtilirken, kimyada Kilojoule/mol (KJ/mol) olarak ifade edilir. Periyodik tabloda, soldan sağa doğru ilerledikçe iyonlaşma enerjisi artarken, aynı gruptaki atomların boyutu büyüdükçe iyonlaşma enerjisi azalır. Bu artışın sebebi, atomların çekirdeğe olan elektriksel çekim gücünün artmasıdır. Atom çapları küçüldükçe çekirdeğe olan bağlanma kuvveti artar ve bu bağı koparmak için daha fazla enerji gereklidir. Değerlik elektron sayısı, temel enerji seviyesi, elektron alışverişi ve elektron ilgisi gibi faktörler, iyonlaşma enerjisini etkileyen unsurlar arasındadır.
Periyodik tabloda bazı istisnalar bulunabilir. Örneğin, borun ilk iyonlaşma enerjisi, berilyumununkinden daha düşüktür. Benzer şekilde, oksijenin ilk iyonlaşma enerjisi değeri, azotununkinden daha düşüktür. Bu istisnalar genel kuralı değiştirmez, ancak özel durumları gösterir. İyonlaşma enerjisinin nasıl değiştiği, kimyasal reaksiyonlarla ilgilenen araştırmacılar için önemli bir konudur. İyonlaşma enerjisi genellikle grup boyunca aşağıdan yukarıya doğru artar ve bu değişimler bir elementin bulunduğu grup numarası hakkında bilgi verir.